
- 温医首页 | 加入收藏 | English
- Genome Biology | 宋伟宏院士团队揭示黑色素瘤发生和发展的新机制
- 作者: 编辑: 来源: 浏览:; 时间:2023年10月31日 15:22
-
2023年10月30日,加拿大健康科学院院士、温州医科大学学术副校长、老年研究院院长宋伟宏院士团队联合天津医科大学基础研究院李俊教授团队和天津医科大学肿瘤医院杨吉龙教授团队在基因组学顶级期刊《Genome Biology》(中科院一区Top,五年影响因子17.4)上在线发表突破性研究成果-“Landscape of enhancer disruption and functional screen in melanoma cells”(genomebiology.biomedcentral.com/articles/10.1186/s13059-023-03087-5)。温州医科大学为本文的第一完成单位。
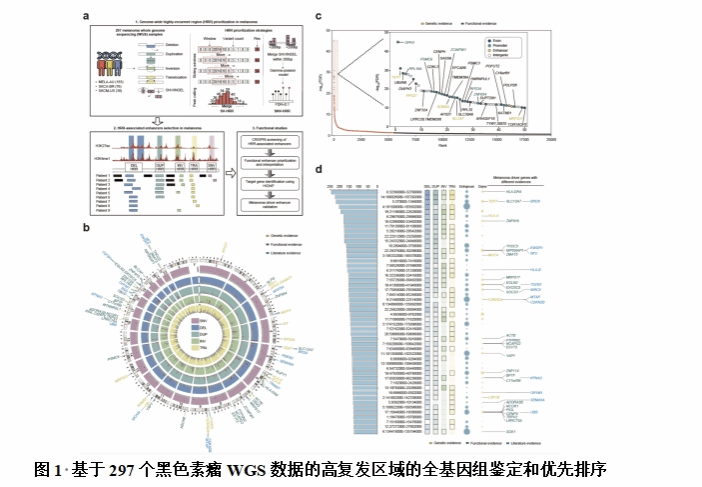
黑色素瘤是最具侵袭性和恶性的肿瘤之一,死亡率很高,全球每年有超过5万人死亡。先前的大规模基因组测序研究已经在不同类型的黑色素瘤中鉴定了许多可能的癌症基因和热点。然而,基于最普遍的显著突变基因(包括BRAF、RAS和NF1等)的分类模式,大约15%的皮肤黑色素瘤和超过50%的黏膜、肢端黑色素瘤患者是未分类的。很少有研究系统地描述蛋白质编码基因之外的基因组事件及其在黑色素瘤进展中的功能。主要的挑战来自黑色素瘤基因组的主要高突变负荷,其具有可归因于紫外线辐射的C>T核苷酸转换特征。这阻碍了仅依靠基因组测序和计算建模从背景突变中识别真正的黑色素瘤驱动因素,特别是在非编码基因组区域的突变。因此,整个黑色素瘤基因组的高突变率对从背景突变中对真正的驱动因素事件进行分层提出了重大挑战。许多反复出现的非编码区域改变,如增强子中的改变,可以影响肿瘤的进展,从而突出了系统破译黑色素瘤增强子破坏的重要性。
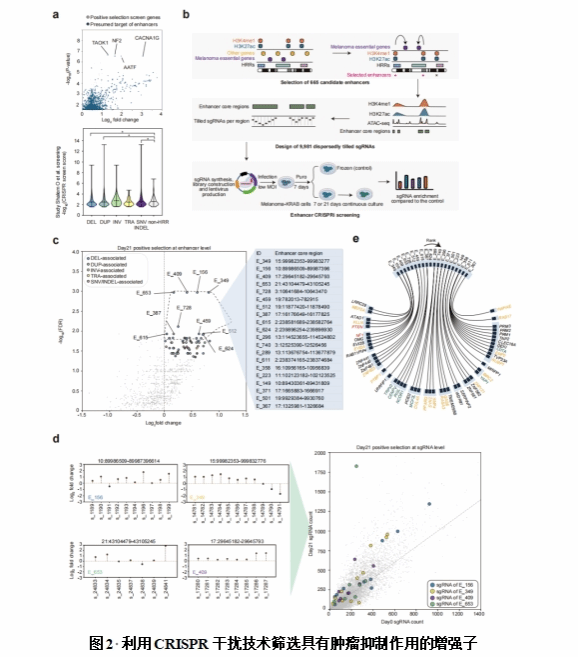
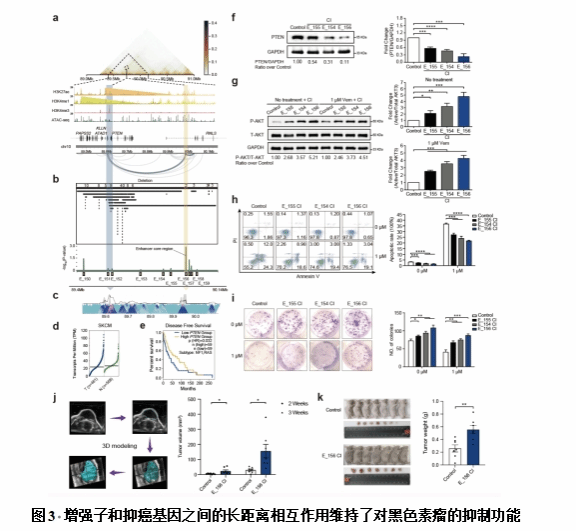
研究团队开发算法,利用297个黑色素瘤全基因组测序样本来排优化高复发区域。通过对黑色素瘤细胞中的高复发区域相关增强子进行基因组规模的CRISPR干扰(CRISPRi)筛选,鉴定了66个可能具有肿瘤抑制作用的显著增强子靶标。这些功能性增强子在黑色素瘤中显示出独立于经典显著突变基因的独特突变模式。对这些重要功能性增强子的靶基因分析揭示了许多已知和潜在的黑色素瘤发展机制。利用广泛的细胞、动物实验和黑色素瘤样本,揭示了一个超级增强子可以通过靶向一个新的黑色素瘤致病基因-MEF2A调节黑色素瘤细胞增殖,而另一个远端增强子能够通过基因组长距离相互作用维持PTEN肿瘤抑制潜力。总之,该研究系统性建立了一个黑色素瘤发生和发展中的关键增强子及其靶基因目录,阐明了鉴定黑色素瘤驱动基因失调的新机制和新的靶向治疗策略,对深入理解黑色素瘤的发生和发展以及临床治疗具有重要意义。
宋伟宏院士的博士后王朝博士,温州医科大学科研中心梁倩博士和天津医科大学硕士生罗梦涵、博士生赵珂是本文的共同第一作者,宋伟宏院士、李俊教授、杨吉龙教授和王朝博士是文章的共同通讯作者。工作得到了国家重点研发项目、国家自然科学基金项目、天津市科委以及瓯江实验室主任基金项目的资助。
浙ICP备12004924号 访问量统计:0021230202
