
- 温医首页 | 加入收藏 | English
- 我院本科生科研兴趣小组在国际权威期刊JCR发表研究成果
- 作者: 编辑: 来源: 浏览:; 时间:2024年01月22日 13:34
-
2024年1月20日,老年研究院院童志前研究员指导的本科生科研兴趣小组(组长-谷子琦)在国际权威期刊Journal of Controlled Release(I区Top期刊,IF=10.8)在线发表了题为PEGylated-liposomal astaxanthin ameliorates Aβ neurotoxicity and Alzheimer-related phenotypes by scavenging FA的研究性文章,在国际首次报道了偶联聚乙二醇2000(PEG-2000)的虾青素脂质体递送至脑部后通过消除海马中过度蓄积的甲醛并挽救AD模型鼠空间记忆。
阿尔茨海默症(Alzheimer’s disease, AD)已成为全球严重的公共卫生问题。童志前课题组前期研究发现,内源性甲醛(FA)在脑内的病理性蓄积是AD发生发展的重要原因。甲醛的蓄积与老年斑的生成可形成正反馈机制,相互刺激,促进AD的发展。消除小鼠脑中蓄积的甲醛可能是治疗AD的潜在方法,但尚无可靠的载药平台可以穿透血脑屏障以消除脑内的甲醛。
本文首次报道了虾青素(ATX)消除甲醛的潜力,并开发了偶联PEG的直径<100 nm的功能化载药颗粒(PEG-ATX@NPs)。通过评价形态特征、稳定性、释放曲线和细胞毒性,PEG-ATX@NPs相较于普通虾青素脂质体(ATX@NPs)有显著优势,在体外显示出显著的甲醛消除作用,抑制了甲醛介导的Aβ交联。
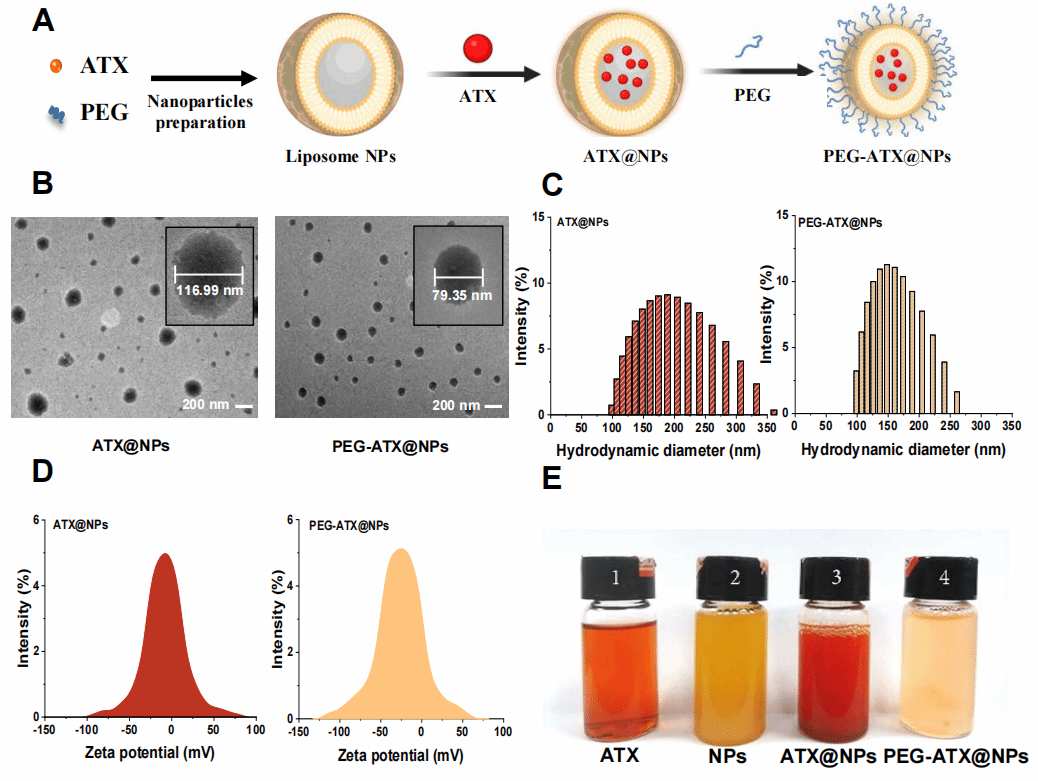
该研究评估了PEG-ATX@NPs的药动学和药效学。在体内,相较于游离的ATX,PEG-ATX@NPs表现出优秀的对甲醛的消除能力,即使单次给药,也可以降低AD模型鼠海马甲醛水平并维持较长时间。经过30天的连续给药后,AD模型鼠脑内的甲醛水平恢复至正常,Aβ蓄积减少,空间记忆得到改善。进一步研究发现,AD模型鼠脑细胞的氧化应激水平降低,甲醛代谢酶系统得到激活。
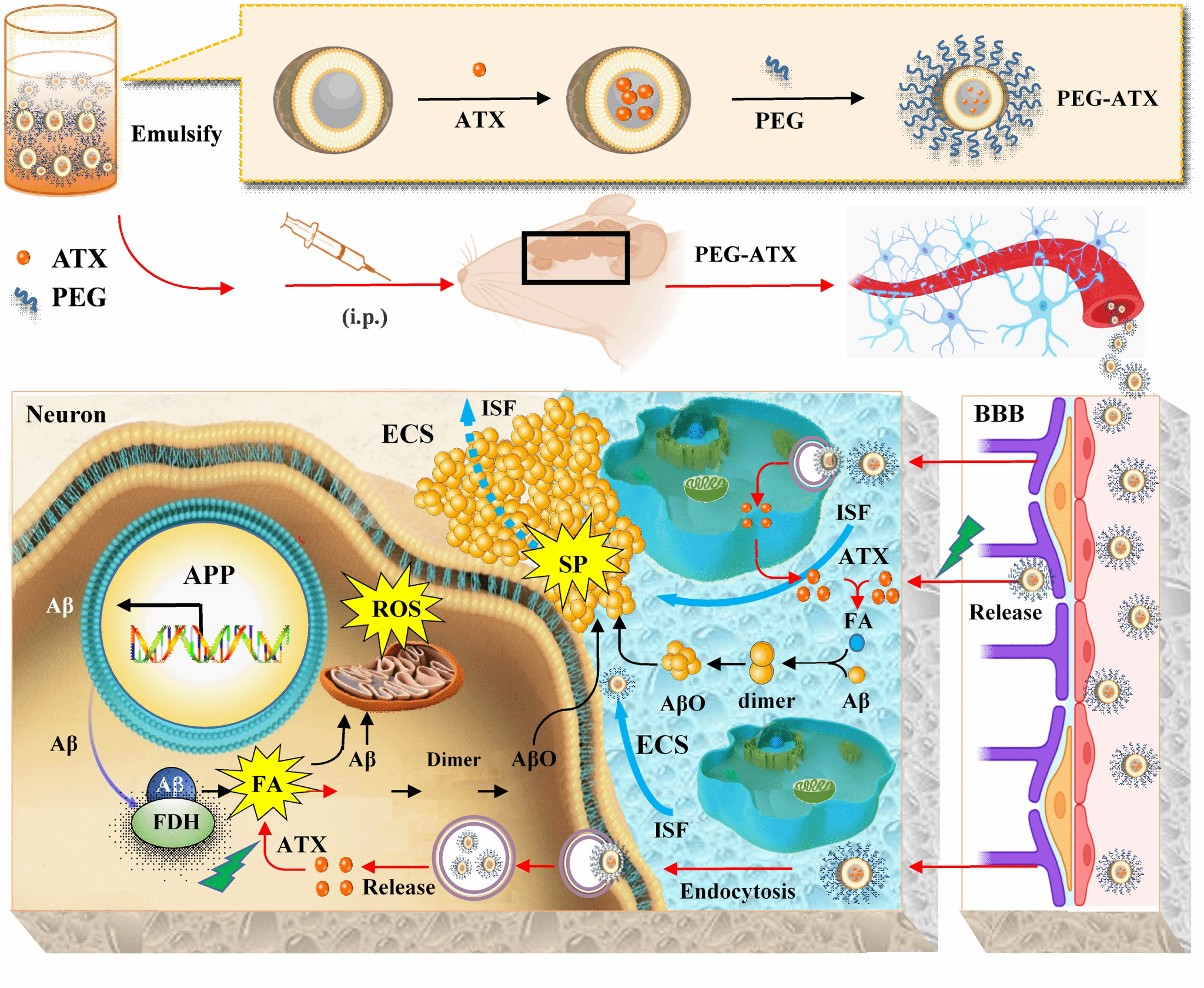
该研究首次开发了偶联PEG的小粒径ATX脂质体用于消除脑内的甲醛,具有良好的稳定性和生物相容性,在体内和体外实验中都显示出优秀的治疗AD的潜力。PEG具有广为人知的安全性,被多种经FDA批准的纳米药物(如Doxil, Onyvide等)所使用。ATX同样具有较大的安全剂量范围。因此,PEG-ATX@NPs具有很大的临床转化潜能。作为一种纳米药物,PEG-ATX@NPs更符合纳米医学的转化医学要求。
我院谷子琦(2020级本科生)、赵夯(硕士研究生)为本文的共同第一作者。本科生宋毅澜、杨婉婷、黎翔、丁翎亦有重要贡献。我院童志前研究员为最后通讯作者。该研究得到了国家自然重大科学基金(62394314),国家自然科学面上基金(82071214),瓯江实验室人才启动经费(OJQDSP2022011),浙江省新苗人才计划(2022R413A034)等资助。
期刊介绍:Journal of Controlled Release是医学/药学领域顶级刊物,中科院一区TOP期刊,影响因子(2023)为10.8。该期刊主要接收关于药物传递和药物释放等相关领域的研究成果,具体包括但不限于药物传递系统、靶向传递、缓释技术、药物载体等方向。
团队介绍:我院童志前研究员团队长期致力于神经退行性疾病与抑郁障碍等精神疾病的潜在靶点的研究,此外从事于光生物调节途径、设备与纳米药物的开发,近年来在Molecular Psychiatry, Journal of Controlled Release, Ageing Research Review等发表多项成果。
撰稿:童志前课题组
浙ICP备12004924号 访问量统计:0021230202
