
- 温医首页 | 加入收藏 | English
- STTT|温医大老年研究院宋伟宏团队吴伊丽课题组开发丁酸工程酵母缓解阿尔茨海默病新策略
- 作者: 编辑:王思瑶 来源: 浏览:; 时间:2025年11月18日 16:11
-
阿尔茨海默病(AD)是老年期最常见的神经退行性疾病,脑内沉积形成的淀粉样斑块是其核心病理特征之一,目前临床尚缺乏有效干预手段。近年研究表明,肠道菌群失调及其代谢产物短链脂肪酸(如丁酸)的缺乏,可能与AD的发生发展密切相关。然而,丁酸在AD中的具体作用机制尚不明确,且现有丁酸补充方式存在代谢快、生物利用度低等局限。
2025年11月17日,温州医科大学老年研究院宋伟宏院士、吴伊丽教授联合天津大学合成生物与生物制造学院、合成生物技术全国重点实验室黄鹤教授团队,在《Signal Transduction and Targeted Therapy》杂志(影响因子52.7)在线发表题为“Engineered butyrate-producing yeasts mitigate Alzheimer-associated phenotypes”的研究论文。该研究通过自主研发的产丁酸工程酵母J17,有效补充AD模型小鼠体内丁酸水平,显著减轻Aβ病理并改善认知功能,系统阐释了丁酸通过调节BACE1介导的Aβ生成及小胶质细胞功能发挥神经保护作用的新机制。这一成果为基于微生物-肠-脑轴的AD干预策略提供了重要理论依据和潜在治疗靶点。

丁酸作为短链脂肪酸的重要成员,主要由肠道微生物发酵膳食纤维产生,不仅参与维持肠道屏障功能与免疫平衡,还可通过血脑屏障发挥抗炎、抗氧化及神经保护作用。尽管丁酸在中枢神经系统中的有益效应已被报道,但其在AD中的具体调控机制及高效递送方式仍是领域内难点。研究团队发现,AD模型小鼠外周血及脑内丁酸水平显著降低,而通过口服工程酵母J17可持续稳定地补充丁酸,逆转这一缺陷(图1)。
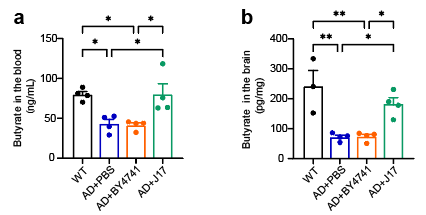
图1.小鼠血液和大脑中的丁酸水平。
进一步机制研究表明,J17干预可通过两条途径协同缓解AD相关表型:一方面,丁酸显著抑制β-分泌酶(BACE1)的表达及其介导的淀粉样前体蛋白(APP)剪切过程,减少Aβ生成;另一方面,丁酸可调节小胶质细胞功能状态,抑制促炎因子(如TNF-α、IL-1β、IL-6)释放,增强抗炎因子IL-10水平,进而促进Aβ清除(图2)。此外,J17还能重塑AD小鼠肠道菌群结构,减少神经毒性代谢物积累,从多维度改善肠道-脑轴功能失调。
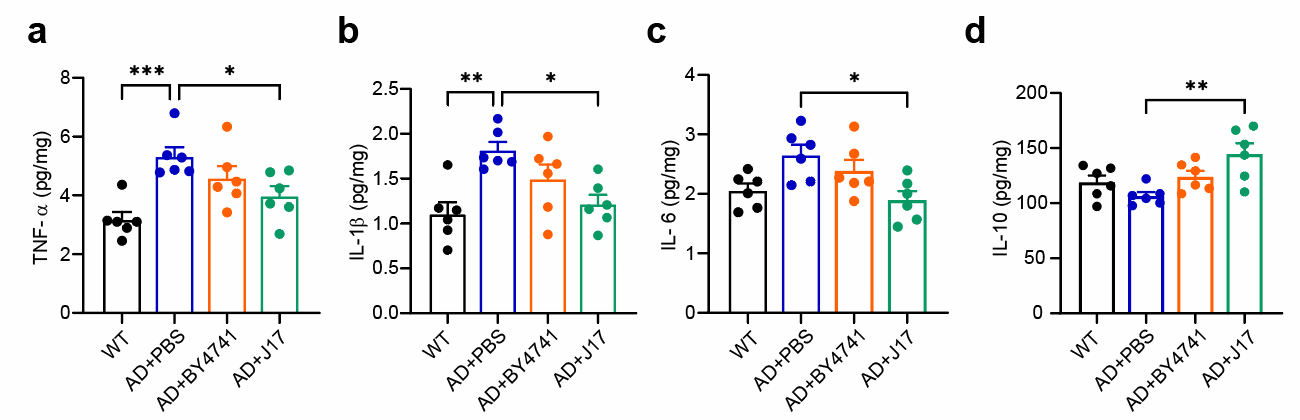
图2. 小鼠皮层中TNF-α、IL-1β、IL-6和IL-10的水平。
行为学实验证实,经J17处理的AD小鼠在Morris水迷宫测试中逃逸潜伏期显著缩短,目标象限停留时间延长,认知功能得到明显改善。病理分析显示,小鼠脑内Aβ斑块沉积减少,小胶质细胞活化受到抑制,神经炎症反应减轻(图3)。这些效应在仅施用底盘益生菌的对照组中未达到统计学显著性,提示丁酸与益生菌的协同作用可能是J17发挥疗效的关键。
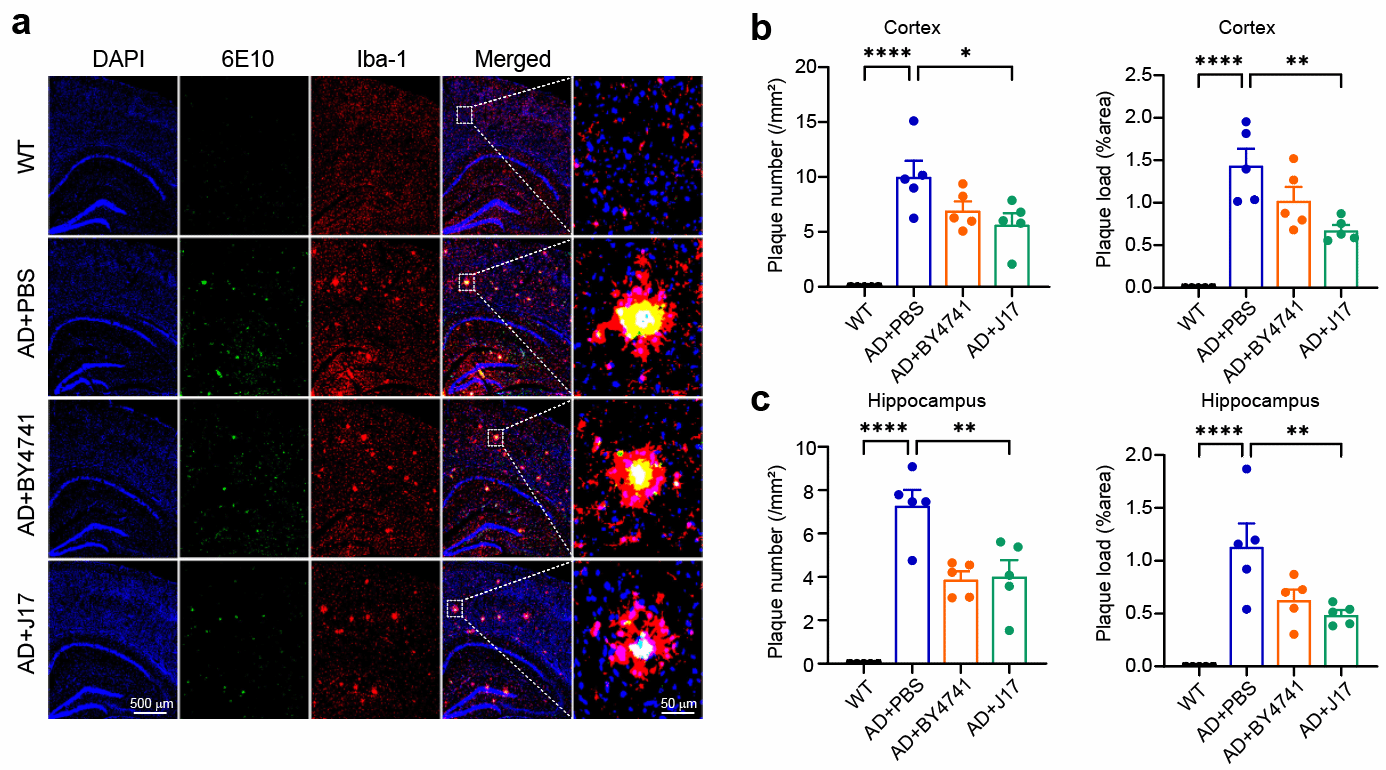
图3. J17抑制了AD小鼠脑内小胶质细胞的活化、减少了Aβ斑块的沉积。
该研究不仅揭示了丁酸通过多靶点调控Aβ代谢与神经炎症的作用网络,还创新性地将合成生物技术应用于神经退行性疾病干预,为开发基于微生物-肠-脑轴的AD治疗策略提供了新思路。研究成果有望推动工程菌制剂在神经精神疾病领域的临床转化与应用拓展。
温州医科大学宋伟宏院士团队吴伊丽课题组孙志羽博士与天津大学合成生物与生物制造学院博士研究生张彪为论文共同第一作者,吴伊丽教授和黄鹤教授为本文的通讯作者。
研究获国家重点研发计划、国家自然科学基金及浙江省、天津市科技计划等项目支持。
原文链接:https://www.nature.com/articles/s41392-025-02474-7
供稿:张彪、孙志羽
浙ICP备12004924号 访问量统计:0021230202
