
- 温医首页 | 加入收藏 | English
- A & D 两篇连发!王贞教授团队发现视网膜微血管成 AD 早期识别 “窗口”,APOE ε4 基因型揭示核心调控机制
- 作者: 编辑:王思瑶 来源: 浏览:; 时间:2026年01月29日 15:42
-
阿尔茨海默病(Alzheimer's Disease, AD)作为常见的神经退行性疾病,其早期诊断一直是医学界的重大挑战。随着检测技术的发展,研究视角逐渐从传统中枢神经系统转向更易于无创监测的外周系统,试图寻找能够反映AD早期病理改变的“生物学窗口”。视网膜作为中枢神经系统的延伸,其微血管变化近年来成为AD早期识别与机制研究的热点。
近期,温州医科大学附属第一医院王贞教授团队在国际权威期刊《Alzheimer's & Dementia》上连续发表两项重要研究,系统揭示了视网膜微血管变化与AD病理之间的关联,以及APOE ε4基因型在此过程中的关键作用,为AD的早期筛查、疾病监测与机制理解提供了新方向。
视网膜微血管变化与AD血浆生物标志物及脑小血管病理相关
题为“Retinal Microvascular Alterations in Alzheimer’s Disease: Linking Blood Plasma Biomarkers and Cerebral Small Vessel Pathology”的研究论文,通过眼底彩照(CFP)、血浆生物标志物检测(Aβ42、Aβ42/40、p-tau181、p-tau217)和脑部磁共振成像(MRI),对视网膜微血管指标血管密度(VD)和分形维数(FD)、SVD相关标志物(如白质高信号等)以及内侧颞叶萎缩(MTA)进行联合分析,进而明确视网膜微血管变化与AD患者血浆生物标志物之间的关联,以及与AD相关SVD指标之间的关系。研究发现,视网膜微血管变化可能与AD的病理进程密切相关,提示视网膜或许可作为评估AD早期病理变化的非侵入性窗口。
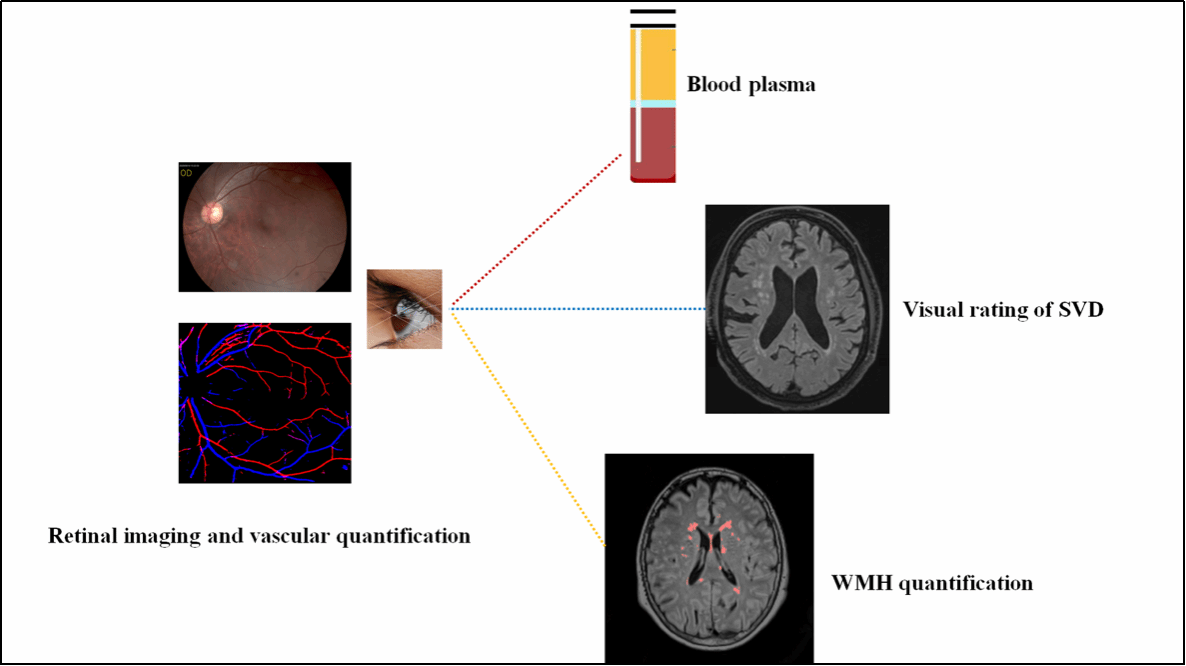
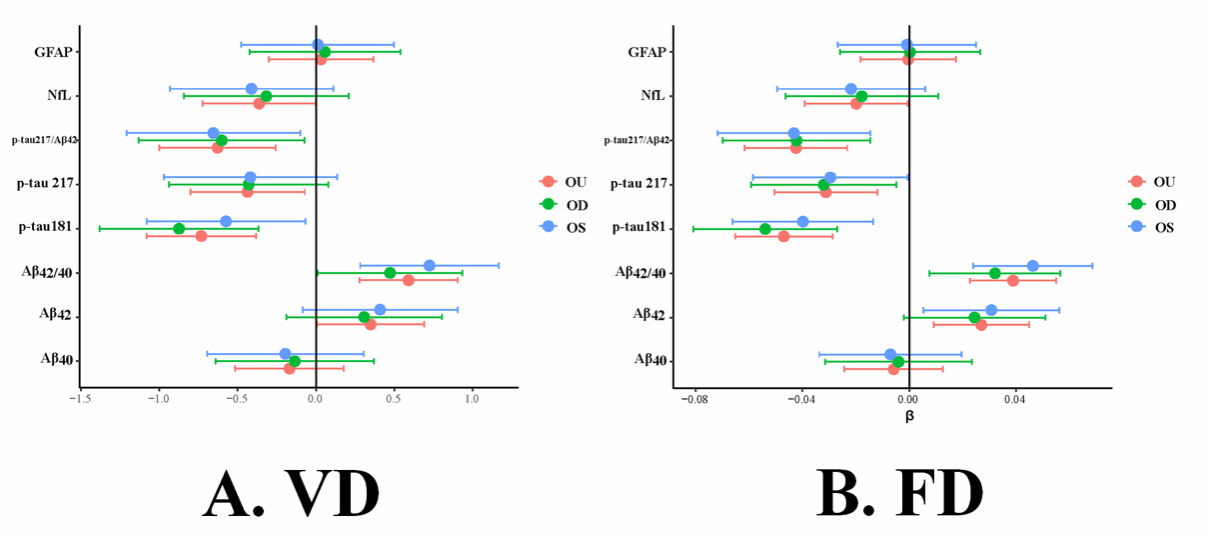
图1. AD患者中视网膜微血管与血浆分析物的相关性
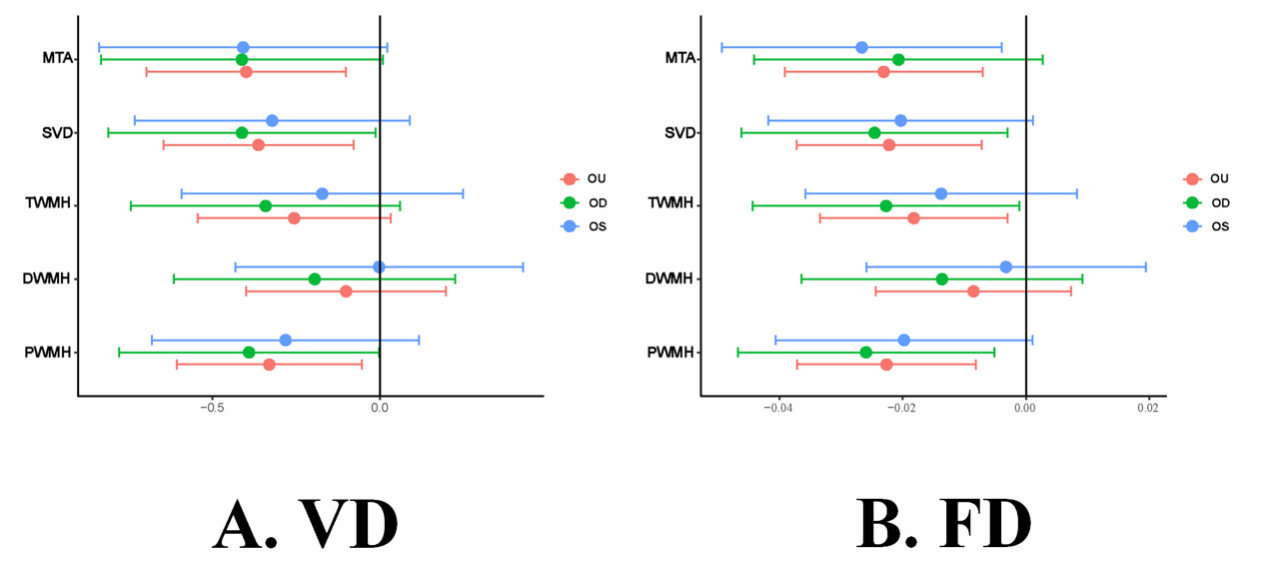
图2. AD患者中视网膜微血管与SVD视觉评分的相关性
APOE ε4 纯合子加剧 AD 视网膜与脑部微血管损伤
在上述研究的基础上,后续题为“APOE ε4 Homozygosity Exacerbates Retinal and Cerebral Microvascular Dysfunction in Alzheimer's Disease: A Mediation Analysis of Vascular Contributions to Cognitive Decline”的研究中,团队进一步聚焦于关键遗传风险因子APOE ε4,深入探讨了基因型如何通过微血管通路影响认知功能。
通过光学相干断层扫描血管造影(OCTA)技术、血浆生物标志物检测(Aβ42、Aβ42/40、p-tau181、p-tau217)和脑部磁共振成像(MRI),精准量化视网膜浅层血管复合体(SVC)和深层血管复合体(DVC)的血管密度,评估视网膜微血管完整性;通过骨架化平均弥散率峰宽(PSMD)指标,反映脑部小血管疾病(SVD)和白质微结构损伤。
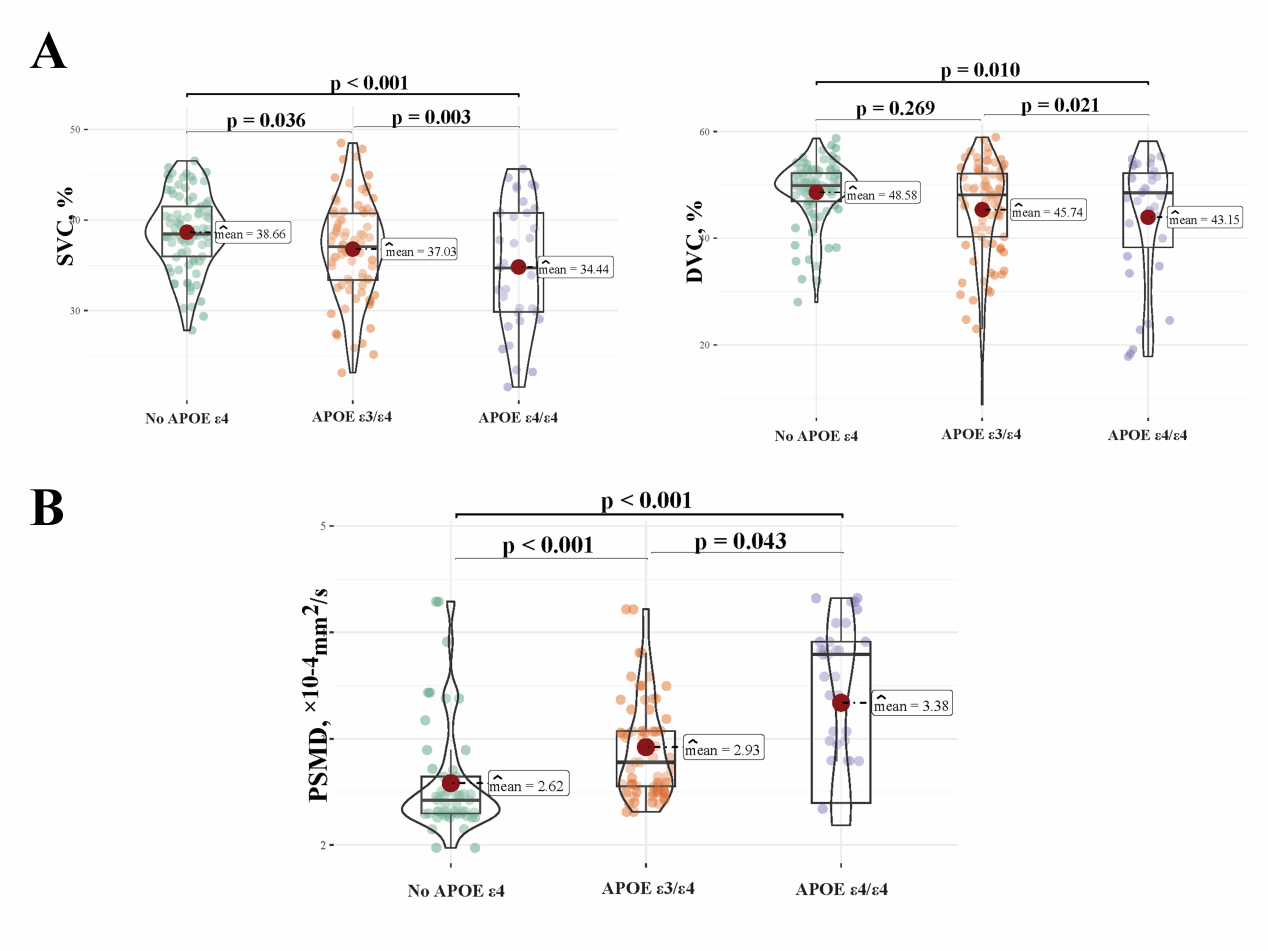
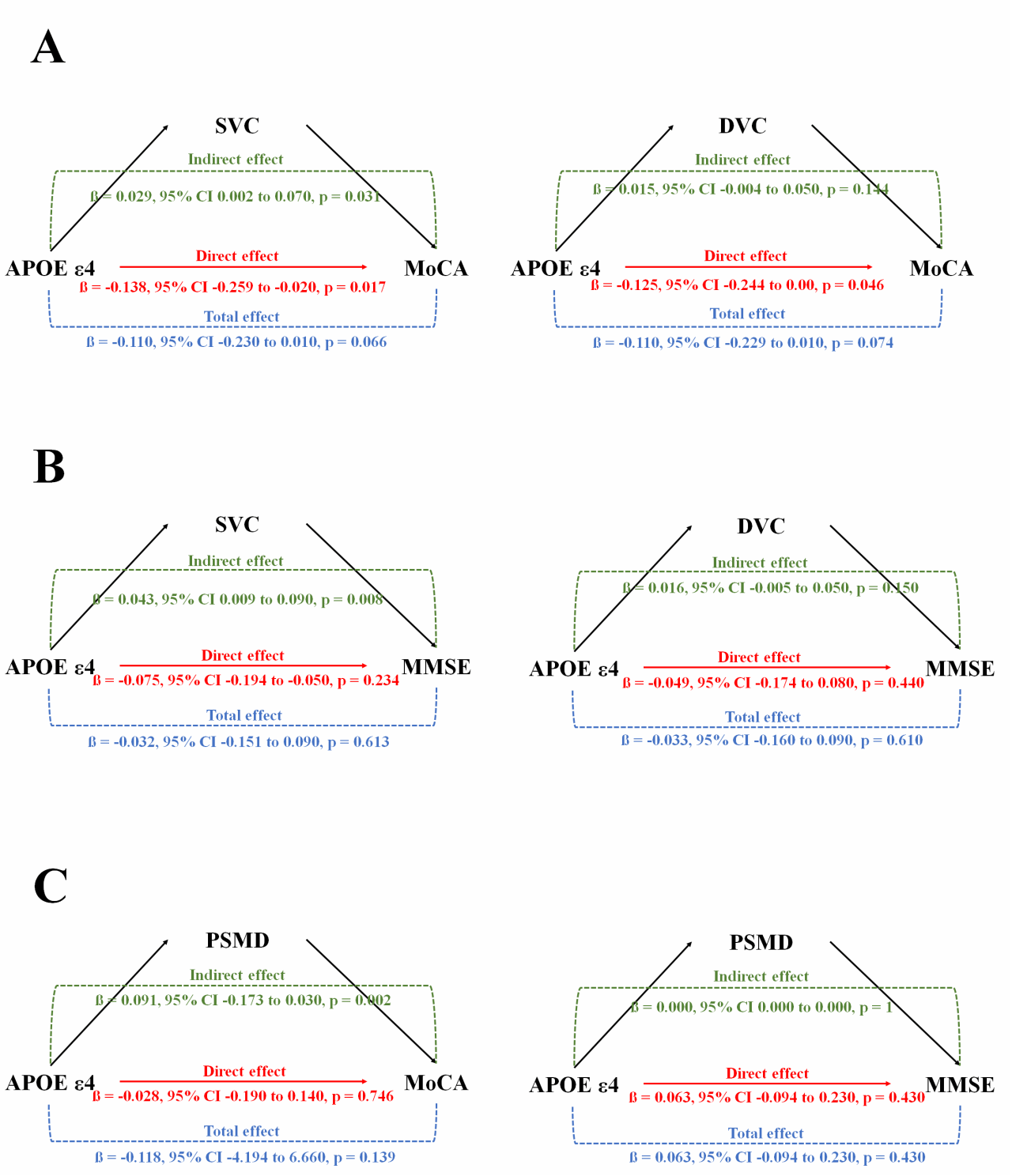
该研究系统揭示了APOEε4基因型通过调控视网膜与脑部微血管功能,进而影响 AD 患者认知功能的关键机制,为疾病的精准诊断与靶向治疗提供了新的科学依据。
这些发现不仅深化了对AD血管病理机制的理解,也为开发基于视网膜的早期诊断工具和针对微血管功能的干预策略奠定了坚实的科学基础,标志着AD研究在走向无创、精准和早期干预的道路上迈出了关键一步。

王贞,温州医科大学附属第一医院老年医学科副主任,主任医师,高级认知中心负责人,AD中心副主任,副教授,硕士生导师,医学博士;香港中文大学访问学者。
长期从事神经内科临床及科教研工作,主攻认知障碍性疾病;发表SCI及核心论文30余篇,主持和参与多项国家级及省级课题。
担任中华医学会神经心理与行为神经病学学组委员,中国老年医学会认知障碍分会委员,浙江省睡眠研究会阿尔茨海默病精准防治分会副主任委员,浙江省医学会认知与神经心理学组委员,浙江省医师协会认知学组委员,浙江省科学协会精神分会委员,温州市医学会心身医学分会候任主任委员。
原文链接:
https://pubmed.ncbi.nlm.nih.gov/41065118/
https://pubmed.ncbi.nlm.nih.gov/41395713/
供稿:王贞教授团队
审核:赵东栋
浙ICP备12004924号 访问量统计:0021230202
